
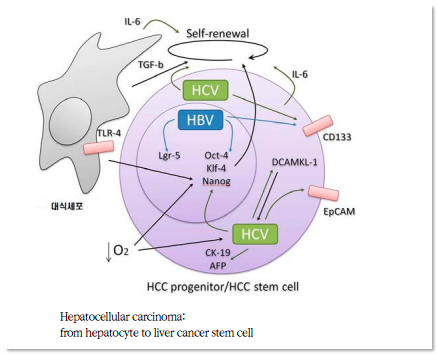
정상세포와 비교하여 암세포의 후생적인 차이는 특정 지역의
포로모터 부분이 고메틸화 되어 있고 전체적인 유전체는 저메틸화
되어 있습니다. 프로모터 부분 즉 종양억제 유전자 프로모터 부분이
메틸화 되어 있으면 종양을 억제시키는 유전자가 발현하지 못하고
다른 저메틸화 된 유전자들은 매우 불안정하게 됩니다.
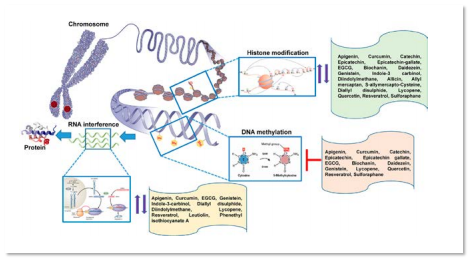
암세포를 후생적으로 분석하면 비정상적인 메틸화를 발견하게 됩니다.
이러한 비정상적인 후생성은 부적절한 발현을 유도하여
암을 발생시키게 됩니다.
2010년 발표된 바이러스의 후진 계획에서
바이러스와 숙주세포와의 생존을 위해 치열한 경쟁에서
후생적인 현상이 나타나 있습니다.
암을 발생시키는 일부 아데노바이러스 종양억제 유전자이기도 한 p53을
작용하지 못하게 합니다 p53은 빠르게 번식하는 세포들이 분열하지
못하도록 세포주기를 차단하여, 바이러스측에 보면 이 유전자를 작동하지
못하는데 자신들의 운명이 걸려있습니다.
이들 바이러스는 우선 E1A라는 단백질을 만들어, 세포들이 빠르게
증식하게 하는 E2F1을 작용하게 됩니다.
위에서 설명한것처럼 무한정 세포 번식을 하는 것은
단세포의 특성으로 다세포로 진화되면서 다세포 생물체들은
이런 단세포 자신만을 생각하는 이기적인 특정을
강력하게 규제하는 프로그램을 발달시켜왔습니다.
다세포생물은 현대 암억제 유전자로 활동하는 레티노프라스토마를
활성화 시켜 위험한 E2F1를 꽉 잡아 작동하지 못하게 합니다.
그러나 레트로바이러스는 자신들의 이익을 위해
EA1를 만들어 Rb와 결합하게 하고 E2F1 단백질을 자유롭게
행동하도록 합니다. 이 E2F1 단백질은 ARF 단백질을 활성화시켜
p53을 파괴하는 MDM2 단백질을 만듭니다.
이밖에도 E1B-55K라는 단백질을 만들어 p5e을 파괴합니다.
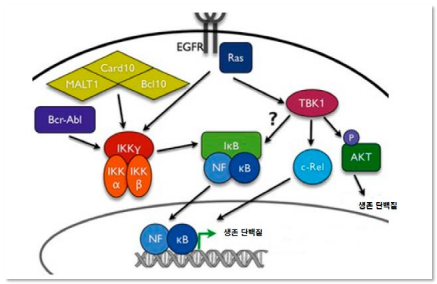
그러나 p53은 빠르게 증식하려는 레트로바이러스에게는 너무나
위험한 단백질입니다. 이를 위해 이 바이러스는 후생적 조절을
이용한 방식을 다시 만들어 냅니다.
E4ORF3 단백질을 만들어 근본적으로 p53 단백질을 만들지
못하도록 p53 유전자에 메틸기를 붙어 완전히 봉쇄해 버립니다.
이는 단세포인 바이러스와 다세포인 숙주와의 전쟁에서
극히 일부만을 나타낸것입니다.
암과의 전쟁도 다세포가 잘 살수 있도록
좋은 환경을 만들어 주지 못한 단세포들의 반란인것입니다.

건강의 꿈! 희망찬 내일!!
brm연구소와 함께하세요^^
오래전부터 이어온 민간요법부터
여러학문, 그리고 현대의학까지!!!
BRM에 많은 관심을 갖고 계신 분들이 상당히 많은데요!!!
brm연구소 박양호 연구실장님의
수요강좌를 통해 암으로 인해
나와 내 가족의 잃어버린 웃음 되찾아보세요!!!
brm연구소 박양호 연구실장님의 수요강좌는
매주 수요일 진행되는 강의로써~
암에 대한 다양한 지식들을
얻어갈수 있는 알찬 강의입니다.
함께하셔서~ 건강에 대한
희망 다시 찾아보세요^^

무단 복제 및 도용은 저작권 침해로 법적 책임을 물을 수 있습니다.
Copyright 2004 by brmchunho.co.kr.All right reserved























![[BRM 상담] PHONE : 02)484.1667, 02)482.2131 HP : 010-5240-6179 FAX : 02)484-1678](../images/copy1.jpg)
